BRAIN MIND & LIFE – BREVI MONOGRAFIE
Il
Neurone per iniziare
____________________________ Giuseppe Perrella & Nicole Cardon ___________________________
Definizione e generalità. La cellula nervosa o neurone è l’unità strutturale e funzionale elementare di quel complesso apparato che prende il nome di sistema nervoso.
Una parte dei neuroni è localizzata nei gangli periferici, ma la maggior parte ha sede nel sistema nervoso centrale (SNC) dove si distinguono due categorie principali di tipi cellulari: i neuroni e la glia. Da un punto di vista fisiologico i neuroni sono alla base di tutte le proprietà funzionali del sistema nervoso e si caratterizzano per essere cellule eccitabili in grado di ricevere e trasmettere impulsi elettrici e, soprattutto, elaborare in forma specializzata gli stimoli ricevuti. Tutti i caratteri dell’esperienza sensoriale e dell’esecuzione dei movimenti, così come l’elaborazione del pensiero, l’apprendimento, il linguaggio ed ogni altra attività mentale, sono possibili grazie all’organizzazione dei neuroni in reti complesse, in grado di consentire lo scambio e l’integrazione di informazioni elaborate in aree diverse del sistema nervoso.
Cenni storici. Rispetto al riconoscimento della struttura cellulata degli altri tessuti, è un’acquisizione relativamente recente che gli elementi nervosi siano cellule, sia per le difficoltà di studio, sia per la resistenza ad accettare l’idea che l’encefalo potesse essere costituito come un organo qualsiasi.
Malpighi osservò per primo il cervello con un apparecchio ingranditore ma, sebbene lo avesse cosparso di inchiostro per aumentare il contrasto, non riuscì a vedere altro che “corpuscoli trasparenti bianchi” che riterrà “piccole ghiandole”. Non sorprende che i progressi della conoscenza in questo campo abbiano seguito il perfezionamento degli strumenti e dei metodi di osservazione. Antoni Van Leeuwenhoek , costruttore di microscopi e straordinario biologo, nel 1718 in una comunicazione alla Royal Society di Londra (1718), fornì la prima pionieristica descrizione della struttura del tessuto nervoso. Nel 1824 Dutrochet descrive “gli elementi che producono l’energia nervosa che le fibre nervose sono destinate a condurre” come “piccole cellule” caratterizzate da un corpo o soma. Valentin, qualche anno dopo, parlerà di “code protoplasmatiche”, cui successivamente si darà il nome di dendriti. Deiters, in una pubblicazione postuma del 1865, già descrive la cellula nervosa come un corpo dal quale si dipartono prolungamenti brevi e numerosi, i dendriti, ed un prolungamento isolato e lungo, l’assone.
Il nome neurone per la cellula nervosa fu proposto nel 1890 da Waldeyer, lo studioso che coniò anche il termine cromosoma. Nel 1897 il fisiologo inglese Sherrington impiegò il termine sinapsi per indicare la struttura specializzata di contatto fra l’assone ed il neurone ricevente.
Si deve all’istologo italiano Camillo Golgi, l’invenzione di una tecnica di colorazione - ora nota come metodo di Golgi - che isolava le singole cellule nervose definendone la sagoma nera come una macchia di inchiostro sullo sfondo chiaro e indistinto. Santiago Ramon y Cajal, impiegando il metodo di Golgi, realizzò un monumentale atlante di cellule nervose dell’uomo e dei vertebrati. Entrambi furono insigniti del premio Nobel nel 1906.
L’evidenza della struttura cellulare del sistema nervoso non aveva messo a tacere del tutto i sostenitori della continuità protoplasmatica fra neuroni, definiti reticolaristi. Costoro sostenevano che nella sinapsi non vi era separazione, ossia negavano l’esistenza di quella che chiamiamo fessura sinaptica. Il dibattito fra coloro che propendevano per una struttura a sincizio o reticolo pluricellulare e quanti sostenevano la “dottrina del neurone”, durò all’incirca dal 1870 al 1950, quando l’introduzione del microscopio elettronico consentì di vedere e fotografare la separazione fra le membrane cellulari.
Classi, forma, struttura e neurotrasmissione. Si distinguono tre classi di neuroni: sensitivi, motori ed interneuroni. I neuroni sensitivi portano gli stimoli dai recettori periferici al sistema nervoso centrale. Fra questi si indicano come neuroni sensoriali quelli delle vie il cui recettore, come nel caso dell’occhio e dell’orecchio, è particolarmente specializzato. Oltre ai cinque sensi ed alle modalità sensitive minori quali la sensazione di equilibrio, l’accelerazione lineare, l’accelerazione angolare, la stima del peso di un oggetto, la percezione del dolore, del prurito e così via, esistono informazioni provenienti dagli organi interni che raggiungono il sistema nervoso autonomo (distinto in ortosimpatico e parasimpatico) grazie ai neuroni viscerosensitivi.
I neuroni motori rappresentano l’uscita del sistema nervoso, la via finale comune per tutte le elaborazioni che portano ad un movimento, sia che si tratti della contrazione della più piccola fibrocellula muscolare, sia che si tratti di un’azione complessa che investe il corpo intero come correre, nuotare, danzare. I neuroni motori sono provvisti di lunghi assoni che terminano sulle fibrocellule muscolari mediante una sinapsi speciale che prende il nome di giunzione neuromuscolare ed impiega l’acetilcolina come mediatore. I motoneuroni conferiscono al muscolo le tre caratteristiche indispensabili per la sua azione: tono, trofismo e riflessi. Come per il versante sensitivo, anche per quello motorio vi sono cellule nervose che fanno capo al sistema nervoso autonomo, si tratta dei neuroni visceroeffettori che innervano la muscolatura liscia involontaria dei visceri, delle ghiandole e dei vasi.
Gli interneuroni hanno assoni brevi che non escono dall’area in cui sono confinate le cellule di appartenenza. Stabiliscono collegamenti, generalmente mediante un’azione inibitoria, fra neuroni di moto e di senso, e sono organizzati in complesse reti che costituiscono uno straordinario comparto di modulazione funzionale.
Ogni cellula nervosa può essere scomposta in tre parti: il corpo cellulare, i dendriti, e l’assone.
Il corpo cellulare, detto anche pirenoforo (portatore di nucleo), è la parte del neurone che più si avvicina alle altre cellule dell’organismo. Al suo interno si possono riconoscere i comuni organuli cellulari ed una caratteristica rete di neurofibrille, costituite da macromolecole proteiche tubulari, ben visibili al microscopio elettronico, ed organizzate come una vera e propria struttura portante, che prende il nome di citoscheletro.
Dal corpo
si dipartono dei prolungamenti, spesso brevi, numerosi e ramificati (dendriti)
ed un prolungamento isolato e lungo (assone); il variare della forma del corpo
e dei suoi prolungamenti determina delle caratteristiche morfologiche che
corrispondono ad altrettanti tipi neuronali: stellati, fusiformi, piramidali,
ovoidali, globosi, granulari. Oppure le cellule possono essere caratterizzate
solo in base al numero di prolungamenti: unipolari, bipolari, multipolari.
Talvolta la terminazione è così particolare da dare nome al neurone: è il caso
delle cellule a canestro del cervelletto in cui l’assone termina
costituendo una vera e propria struttura in forma di canestro intorno ad un
altro elemento nervoso (la cellula gangliare), ed il caso delle cellule a T,
in cui il prolungamento, dopo un tratto rettilineo, si divide in due branche
quasi ad angolo retto con una morfologia che ricorda la lettera dell’alfabeto.
Un neurone può anche essere identificato in base alla sede (midollo spinale,
cervello, cervelletto, ecc.) o alla combinazione di due caratteristiche: cellule
stellate del midollo, cellula piramidale della corteccia, cellula a
granulo del cervelletto.
Un altro modo convenzionale di riferirsi ad un tipo neuronale è indicarlo con l’eponimo del suo scopritore: neurone gigante di Betz (un tipo di cellula piramidale della corteccia), neurone di Purkinje (la cellula gangliare del cervelletto).
Della classificazione di Camillo Golgi è rimasta, nell’uso internazionale, la distinzione in cellule con un assone molto lungo, in grado di raggiungere aree lontane o neuroni del primo tipo di Golgi e neuroni del secondo tipo di Golgi, caratterizzate da un assone più breve che stabilisce un collegamento con cellule della stessa area.
Il corpo delle cellule nervose è caratterizzato anche da estrema variabilità dimensionale, ad esempio i neuroni piramidali della corteccia motrice hanno un diametro medio di 25 micron, ma una loro variante (neurone gigante di Betz) può raggiungere i 70-80 micron; i granuli della corteccia del cervelletto sono fra le cellule più piccole, non superando i 5-6 micron, con un diametro inferiore a quello del globulo rosso (7 micron). La lunghezza dell’assone (vedi dopo) influenza le dimensioni del corpo cellulare, così alcuni neuroni motori del midollo raggiungono i 100-130 micron. Se la grandezza di queste cellule umane sorprende, quella raggiunta dai neuroni radicolari di alcune specie di pesci è veramente impressionante, infatti con i loro 500 micron sono visibili ad occhio nudo.
I dendriti furono così chiamati da His (dendron = albero) che voleva evidenziare la loro caratteristica principale consistente nella ramificazione dicotomica ripetuta e spesso abbondante, tale da ricordare un albero. Deiters li indicava come prolungamenti protoplasmatici, per sottolineare la loro continuità con il citoplasma del corpo della cellula nervosa, caratteristica che hanno in comune con l’assone. I dendriti sorgono spesso in gran numero dal contorno cellulare, talvolta definendo la morfologia della cellula, come accade nel neurone di Purkinje del cervelletto, reso inconfondibile da una spalliera dendritica riccamente arborizzata, contrapposta all’assone.
Tutta la superficie dei dendriti è cosparsa da piccole espansioni simili a gemme, dette spine dendritiche che, con particolari colorazioni e a basso ingrandimento, conferiscono alle ramificazioni un aspetto vellutato.
Da un punto di vista funzionale le ramificazioni dendritiche espandono enormemente la superficie di recezione del neurone.
L’assone o neurite o cilindrasse emerge come prolungamento unico da una regione un po’ ispessita del corpo cellulare detta monticolo assonico e si dirige lontano, potendosi ramificare a distanza dall’origine. Si distingue dai dendriti per molte altre caratteristiche: l’assenza di spine dendritiche, il maggior calibro, la presenza di un rivestimento o guaina mielinica, che conferisce caratteri fondamentali per la trasmissione dell’impulso nervoso, la terminazione in una espansione detta terminazione sinaptica o bottone sinaptico che contiene miriadi di vescicole piene del neuromediatore caratteristico di quel tipo cellulare. Si comprende come le caratteristiche morfologiche siano legate al ruolo funzionale: l’assone conduce l’impulso nervoso lungo la superficie della sua membrana e lo trasmette ad un altro neurone attraverso il rilascio di una molecola (neuromediatore o neurotrasmettitore) in quella struttura specializzata di giunzione fra cellule nervose che prende il nome di sinapsi. All’interno dell’assone il citoscheletro è organizzato in modo da costituire come dei binari, lungo i quali possono essere trasportate molecole, vescicole contenenti il neuromediatore ed organuli come i mitocondri, in grado di fornire energia ai processi che si verificano presso la terminazione sinaptica. Nella malattia di Alzheimer queste strutture proteiche a binario si alterano formando dei grovigli che impediscono il normale funzionamento del neurone.
E’ interessante notare che il calibro del neurite è proporzionale alle dimensioni della cellula di origine, alla lunghezza e all’ampiezza del territorio coperto dalle sue ramificazioni terminali. E’ comprensibile che l’assone di un neurone motorio che dal midollo spinale deve raggiungere le dita delle mani o dei piedi, oltre ad essere tanto lungo abbia un calibro davvero considerevole.
E’ necessaria una
precisazione terminologica perché, se da tempo la Commissione Internazionale
per la Nomenclatura Anatomica (IANC) ha stabilito che neurite, assone e cilindrasse
sono sinonimi, non tutti gli autori seguono questo criterio. Se assone e
neurite si impiegano come equivalenti da molto tempo, al termine cilindrasse,
introdotto da Purkinje, si è dato spesso il suo significato originario di assone
mielinizzato. In questo senso sarebbe cilindrasse l’assone poco dopo
l’origine e prima del terminale sinaptico, cioè solo nei tratti ricoperti dalla
guaina mielinica, e non si potrebbe impiegare questo termine per il neurite
delle fibre non mielinizzate, come alcuni tipi di fibre dolorifiche. Un uso
erroneo, ma divenuto frequente nella letteratura anglosassone sulle malattie
degenerative, è quello che indica collettivamente come neuriti i
dendriti e gli assoni insieme. Quest’uso nasce dalla utilità pratica
nell’impiego di un solo termine per indicare tutti i prolungamenti cellulari
ugualmente interessati da processi distruttivi e si giustificherebbe sulla base
di un riferimento storico a questa accezione semantica del termine neurite,
impiegata da qualche pioniere della neurologia. E’ necessario conoscere
quest’uso, ma è preferibile evitarlo perché ingenera un’inutile confusione.
La conduzione dell’impulso nervoso lungo la membrana dell’assone è un fenomeno attivo e non passivo come quello del passaggio di una corrente elettrica lungo un cavo. In condizioni di riposo l’interno della membrana è carico negativamente e l’esterno positivamente, in modo tale che si crea una polarizzazione che caratterizza la stabilità. La depolarizzazione che segue allo stimolo eccitatorio determina la conduzione dell’impulso fino al terminale sinaptico con il conseguente rilascio del neurotrasmettitore che si lega al recettore della membrana post-sinaptica innescando il processo di propagazione dell’impulso al neurone successivo. Questo schema di neurotrasmissione si verifica nella maggior parte delle sinapsi (sinapsi chimiche), mentre solo in una minoranza di casi la trasmissione dell’impulso avviene senza il passaggio di una molecola nello spazio sinaptico (sinapsi elettriche). Alcuni neuromediatori, invece di determinare la depolarizzazione del neurone post-sinaptico con la conseguente trasmissione dell’impulso, agiscono da iperpolarizzatori e, pertanto, hanno significato inibitorio. Neuromediatori inibitori sono il GABA nel cervello e la glicina nel midollo spinale. La maggior parte delle sinapsi della corteccia cerebrale sono a GABA.
I neurotrasmettitori sono numerosi e, accanto alla amine biogene (dopamina, noradrenalina, adrenalina, serotonina) e all’acetilcolina che, insieme con il glutammato rappresentano le molecole più studiate, vi sono peptidi di basso peso molecolare detti neuropeptidi. In alcuni casi questi peptidi svolgono un’azione modulatrice del neurotrasmettitore principale, ad esempio nella trasmissione dolorifica (peptidi oppioidi), nella sazietà (colecistochinina-pancreozimina), nella sete (angiotensina). In altri casi l’attività dei peptidi può influenzare la plasticità, la crescita e la differenziazione neuronale.
Genesi e rigenerazione dei neuroni. La maggior parte dei neuroni che costituiscono il nostro sistema nervoso è già presente quando nasciamo, ma molte evidenze sperimentali indicano che lo sviluppo di nuove cellule nervose, o neurogenesi, è un processo che continua a verificarsi durante tutta la vita. L’entità e le caratteristiche di questo fenomeno costituiscono uno degli argomenti di ricerca più affascinanti nelle neuroscienze.
Il neurone del SNC è stato ritenuto per molto tempo una cellula straordinariamente specializzata che ha perso la capacità di riprodursi. Questa convinzione era suffragata dall’evidenza dell’incapacità del cervello di riparare la perdita di cellule nervose con la loro sostituzione e dall’osservazione che la memoria di tutto ciò che ciascuno di noi conosce, costituendo la base della propria identità e di ogni altra funzione psichica, si dovesse basare su un’organizzazione stabile in reti di cellule specializzate che sarebbe stata sconvolta dalla sostituzione con nuove cellule prive delle informazioni acquisite durante la vita dell’individuo. Era stato il patologo Giulio Bizzozero (1846-1901), autore del primo trattato italiano di istologia, ad introdurre la classificazione in tessuti labili, come il midollo osseo che continuamente produce cellule del sangue, stabili come quelli di organi quali il fegato, che rigenera cellule solo se perse per lesione, e perenni, come il sistema nervoso centrale. Questa distinzione, a grandi linee ancora valida, obbedisce ad una regola che, come spesso accade in biologia, ha le sue eccezioni (vedi “Neural Regeneration – BM&L Opinion” ). Infatti nel 1928 Santiago Ramon y Cajal riportava che nel 1911 Tello aveva dimostrato che i neuroni perenni del SNC potevano ricrescere se posti in un ambiente speciale come quello costituito da un nervo sciatico in particolari condizioni sperimentali. Una conferma definitiva dei risultati di questa sperimentazione è giunta solo dopo settant’anni da Aguayo, Richardson and Mc Guinness che replicarono gli esperimenti di Tello con nuovi metodi, dimostrando che la mancata rigenerazione delle cellule del sistema nervoso centrale danneggiato non dipendeva da un deficit intrinseco assoluto, ma era in larga misura condizionata dalle caratteristiche biochimiche dell’ambiente tessutale circostante.
Se questi studi dimostravano che l’impossibilità del sistema nervoso centrale di ripararsi, rigenerando le cellule perdute come può fare il sistema nervoso periferico, non è assoluta, nulla aggiungevano al fatto che in condizioni fisiologiche, durante tutta la vita, l’encefalo e il midollo spinale sembravano stabilmente costituiti dagli stessi neuroni, che potevano solo ridursi di numero con l’invecchiamento. Eppure, già nel 1962 Joseph Altman aveva rilevato, in quella regione del cervello che prende il nome di Ippocampo, segni evidenti della genesi di nuovi neuroni in esperimenti condotti su ratti, ovvero mammiferi il cui cervello ha molte analogie con quello umano. In seguito Altman evidenziò che le cellule neonate migravano dall’Ippocampo verso altre aree del cervello. Nel 1979 un gruppo di ricerca condotto da Michael Kaplan confermò i risultati di Altman e, quattro anni dopo, nel 1983 lo stesso Kaplan trovò precursori di cellule nervose nel proencefalo di scimmia adulta. La comunità scientifica nutriva, però, ancora molti dubbi sul fenomeno, chiedendosi in base a quali stimoli e per quali necessità fisiologiche potessero essere prodotte nuove cellule e perché il fenomeno fosse quantitativamente tanto limitato da renderne difficilissimo l’apprezzamento. All’inizio degli anni Ottanta Fernando Nottebohm e i suoi collaboratori avevano condotto delle ricerche sulla neurobiologia dell’apprendimento del canto da parte dei canarini, scoprendo che i maschi, il cui canto svolge una funzione di attrazione sulle femmine durante la stagione dell’accoppiamento, andavano incontro ad intensi fenomeni di neurogenesi imparando nuove frasi musicali. Si ipotizzò che le nuove cellule consentissero la creazione di circuiti adatti a conservare le nuove memorie, senza compromettere i circuiti strutturali delle memorie della specie. Inoltre, poiché i nuovi apprendimenti richiedevano la strutturazione di schemi complessi era necessario che le nuove reti neuronali si costituissero nel proencefalo, deputato al controllo di comportamenti più elaborati ed evoluti e, come si è visto, sede dei fenomeni di neurogenesi dimostrati da Kaplan nella scimmia. Nottebohm ipotizzò che processi simili si potessero avere anche nel cervello di mammiferi. Il gruppo di ricerca di Elizabeth Gould dimostrò la presenza di cellule nervose neonate in una specifica area del cervello di scimmia che fu subito indagata anche nell’uomo. Fred Gage e Peter Eriksson dimostrarono per la prima volta nel cervello umano, in un’area corrispondente, la neurogenesi spontanea.
Siamo solo all’inizio di questa nuova avventura di conoscenza, e saranno necessari ancora molti anni di ricerca perché si possa avere un quadro generale del ruolo della neurogenesi nell’economia funzionale del nostro sistema nervoso.
La vita del neurone o lifespan può essere ripartita per comodità descrittiva, anche se un po’ artificiosamente, in quattro fasi corrispondenti ad altrettanti eventi fondamentali: nascita, migrazione, differenziazione e morte.
Nascita. I neuroni si sviluppano in aree cerebrali in cui vi sono alte concentrazioni di precursori di cellule nervose o neural stem cells. Queste cellule sono potenzialmente in grado di generare la maggior parte se non tutti i diversi tipi di neuroni e cellule gliali dell’encefalo.
E’ importante rilevare che tutto ciò che si conosce sulla fisiologia delle cellule stem del sistema nervoso deriva da osservazioni in vitro, cioè condotte nel microambiente artificiale creato in laboratorio. Sebbene si cerchi di riprodurre condizioni prossime a quelle naturali, è ancora impossibile simulare gli innumerevoli segnali e stimoli molecolari, in gran parte sconosciuti, che raggiungono la cellule in vivo.
Anche se c’è ancora molto da scoprire sulle cellule stem, si conoscono i passi fondamentali della loro evoluzione secondo linee che seguono lo schema di un albero genealogico. Alla base, naturalmente, vi è la riproduzione, processo che avviene per semplice divisione cellulare (mitosi) della cellula stem, ma con tre possibili esiti diversi:
1) due cellule stem uguali,
2) una cellula stem e una progenitrice di una linea cellulare,
3) due progenitrici di una linea cellulare.
Nel primo caso la divisione cellulare è funzionale alla riproduzione del pool di cellule stem, pertanto si parla di autorinnovo, nel secondo e nel terzo, invece, la divisione comporta l’acquisizione dei caratteri di una cellula progenitrice, per cui si parla di differenziazione.
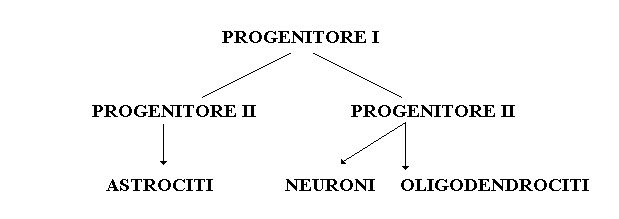
Per differenziazione si intende un processo di specializzazione nelle forme e nella funzione. Un progenitore precoce perde la totipotenza delle cellule stem e, riproducendosi, potrà dar luogo a cellule della propria linea. In particolare, potrà riprodursi autorinnovandosi o, nella divisione, differenziarsi dando luogo a due progenitori di seconda generazione i quali, a loro volta, si potranno differenziare, il primo in astrociti ed il secondo in neuroni o in oligodendrociti.
Migrazione. Quando un neurone è stato generato, l’avventura della sua vita comincia con un viaggio verso quella che sarà la sua sede definitiva di attività. A tale proposito due grandi problemi della ricerca hanno trovato solo una parziale risposta: come fa un neurone a conoscere la sua destinazione? In che modo riesce a compiere il suo percorso?
Alcune acquisizioni sulla migrazione dei neuroni corticali sono molto interessanti, anche se specialistiche. Intanto si può dire, schematizzando, che il viaggio dei neuroni si avvale di almeno due modalità.
1) Alcune cellule nervose migrano seguendo le lunghe fibre della glia radiale. Queste fibre si estendono dagli strati interni a quelli più esterni del sistema nervoso. I neuroni scorrono lungo le fibre finché non giungono a destinazione.
2) Le cellule nervose viaggiano usando segnali chimici. Alcune speciali molecole presenti sulla superficie dei neuroni, le molecole di adesione, si legano a simili molecole presenti sulla superficie della glia o su assoni di altri neuroni vicini. Queste molecole fungono da segnali-guida per la destinazione finale.
Differenziazione. Raggiunta la sede definitiva, ogni neurone dovrà assumere uno specifico ruolo funzionale. Questa fase finale del processo di differenziazione è quella meno conosciuta. E’ noto che la distribuzione topografica, fin dallo sviluppo embrionale, ha un preciso valore funzionale ed è sotto il controllo di omeogeni, ma i criteri morfo-funzionali che presiedono all’organizzazione delle varie strutture definendone la citoarchitettonica e la fisiologia sono vari e complessi, spesso obbedendo a vincoli filogenetici, altre volte seguendo priorità neurochimiche legate al tipo di trasmettitore. Si va dai livelli più semplici di organizzazione segmentaria con una definita ripartizione fra neuroni sensitivi, interneuroni e neuroni motori, come accade nel midollo spinale, alla struttura della corteccia cerebrale in cui i principi organizzativi sono così complessi da apparirci, allo stato attuale delle conoscenze, come un vero labirinto concettuale. Eppure, per comprendere meglio la logica dei processi di differenziazione, sarà necessario approfondire la conoscenza fra localizzazione e funzione. Una grande parte del nostro sistema nervoso ha un’organizzazione somatotopica, ossia ad un’area topografica del corpo corrisponde una specifica area neuronale, a gruppi di aree di una estesa regione, come gli arti, il tronco o la testa, corrispondono topograficamente gruppi di aree nel sistema nervoso che conservano in parte i rapporti delle aree periferiche. Per questo un neurone migrato nella corteccia, a seconda della zona in cui si fermerà, potrà differenziarsi, ad esempio, come cellula in grado di ricevere la sensibilità dalla cute della palpebra o, all’opposto, potrà essere deputato al movimento delle dita dei piedi.
Nel corso dello sviluppo embrionale, un neurone dipende da segnali molecolari provenienti da altre cellule, quali gli astrociti, che contribuiscono a determinarne la forma, la localizzazione, il tipo di neurotrasmettitore che produrrà e a quali altri neuroni dovrà collegarsi. Nel cervello adulto, in cui i circuiti neuronali sono già sviluppati ed obbediscono a precisi piani d’azione funzionale, non si comprende bene come le nuove cellule prodotte possano differenziarsi rendendosi adatte a reti modellate dall’azione dell’ambiente e dall’esperienza specifica di un singolo individuo. Probabilmente questi fattori rappresentano un’importante limitazione per il recupero nel danno cerebrale. Tuttavia, il pur modesto fenomeno di genesi di nuovi neuroni durante la vita adulta è seguito da un processo di differenziazione, oggetto di studio in vari progetti di ricerca: molte evidenze sperimentali fanno supporre che gli astrociti possano avere nel cervello adulto un ruolo simile a quello svolto nella vita endouterina.
Morte. Sebbene si tratti delle cellule con la maggiore durata di vita, molti neuroni muoiono durante la migrazione, la differenziazione e nel corso dell’esistenza di un individuo. E’ necessario distinguere il fenomeno di morte cellulare inteso in senso generale (necrosi) dal fenomeno di morte cellulare programmata o apoptosi. La morte programmata dei neuroni è parte del processo di differenziazione dell’encefalo, rappresentando in questo caso un evento fisiologico legato alla selezione durante lo sviluppo. In molte malattie neurodegenerative si determina la comparsa di una anomala o precoce apoptosi .
La ridotta vita dei neuroni è alla base di una lunga lista di condizioni patologiche che riguardano il SNC, anche se il danno è di volta in volta caratterizzato da diversi tipi di lesione.
Il danno cerebrovascolare acuto da ictus cerebrale causa focolai in cui i neuroni muoiono (necrosi), talvolta lentamente per mancanza di O2 e metaboliti (necrobiosi), un quadro simile si può determinare per lesioni traumatiche. Nella malattia di Huntington una mutazione genetica causa l’iperproduzione del neurotrasmettitore glutammato, con la conseguente morte di neuroni nei nuclei della base: il rilascio di glutammato in eccesso è una modalità tipica di morte cellulare neuronale. Nella malattia di Alzheimer una complessa patogenesi caratterizzata da placche infiammatorie dovute all’accumulo di un peptide patologico e alla formazione di aggregati endocellulari di proteine strutturali, esita nella morte precoce di molti neuroni. Nel morbo di Parkinson la morte precoce, massiva e selettiva dei neuroni a dopamina della Sostanza Nera , una formazione mesencefalica che proietta i suoi assoni ai neuroni del Corpo Striato nei Nuclei della base , è all’origine della patogenesi ed è il primum movens di tutta la sintomatologia[1].
